喜讯:2015年高考真题——理综化学(新课标Ⅱ卷) 26题 命中 14分2015-07-09 8:41:00 阅读 次 参与讨论()马上投稿
|
喜讯:2015年高考真题——理综化学(新课标Ⅱ卷) 26题 命中 14分 2015年高考真题——理综化学(新课标Ⅱ卷) http://www.ks5u.com/down/2015-6/29/1798197.shtml 命中试题:北京市大兴区2015届高三上学期期末考试化学试题 Word版含答案 http://www.ks5u.com/down/2015-2/4/1639599.shtml 【高考真题】 26.(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示: 溶解度/(g/100g水)
回答下列问题: (1)该电池的正极反应式为 (2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经 (3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 (4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。 【答案】(1)MnO2+e—+H+=MnOOH;Zn+2MnO2+2H+=Zn2++2MnOOH (2)0.05g (3)加热浓缩、冷却结晶;铁粉、MnOO
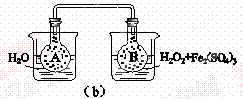
【命中试题】 【北京市大兴区2014~2015学年度高三第一学期期末试卷】(11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。 (1)请写出H2O2的电子式 。 (2)H2O2分解过程的能量变化如图(a)所示,试判断该反应为 反应(吸热或放热)。 ①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
完成第二步反应的离子方程式: ②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)
试回答:
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。 【答案】(11分) (1) (2) 放热(1分) ①2 1 2H+ 2 Fe3+ 2H2O (2分) ②深 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动(2分) (3 (4)H2O2+2H++Cu=Cu2++2H2O (1分) 温度升高H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低(2分) |
网友评论
云南省玉溪第一中学2025-2026学年高一上学期开学考试(新)
云南省玉溪第一中学2025-2026学年高一上学期开学考试(新)