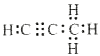喜讯:2016年高考真题——理科综合化学(天津卷) 第7题 共命中42分(3)2016-07-06 17:46:00 阅读 次 参与讨论()
|
喜讯:2016年高考真题——理科综合化学(天津卷) 第7题 共命中42分(3) 【高考真题】 7.(14分)下表为元素周期表的一部分。
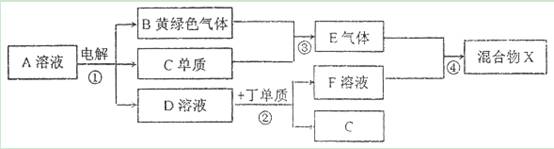
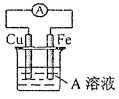
回答下列问题 (1)Z元素在周期表中的位置为__________。 (2)表中元素原子半径最大的是(谢元素符号)__________。 (3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________; a.Y单质与H2S溶液反应,溶液变浑浊 b.在氧化还原反应中,1molY单质比1molS得电子多 c.Y和S两元素的简单氢化物受热分解,前者的分解温度高 (4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。 (5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。 (6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。 【答案】(1)第三周期,ⅦA族 (2)Si (3)ac (4)Si(s)+2Cl2(g)=SiCl4(l) △H=-687kJ/mol (5) (6)NO 0.9mol;NO2 1.3mol;2mol 【命中试题】 1.【天津市河西区2016届高三下学期总复习质量调查(一)理科综合试卷 第7题 】 (7)有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
请按要求回答下列问题: (1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为_____________;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是_________________________________________。 (2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为___________。 (3)上图转化关系中不属于氧化还原反应的有(填编号)____________。 (4)接通右图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为______。
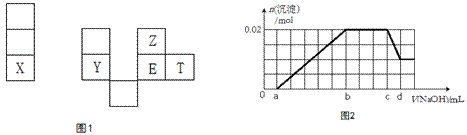
(5)当反应①电解一段时间后测得D溶液pH=12(常温下,假设气体完全逸出,取出交换膜后溶液充分混匀,忽略溶液体积变化),此时共转移电子数目约为________;反应②的离子方程式为___________。 (6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(陈水外)有_________________。 【答案】(14分)(1) 37(2分);依据同主族元素的金属性随核电荷数的增加而增强,推测己单质与水反应较丙更剧烈(1分,合理给分)(2) (4)3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(2分); (5) 2.【天津市河东区2016届高三一模考试理科综合化学试卷 第7题】 (7)X、Y、Z、E、T均为短周期元素,在周期表中的相对位置如图1。X是短周期中原子半径最大的元素; X、Y在同一周期,Y是常见的半导体材料; E的最高价氧化物对应水化物有强脱水性。
根据判断出的元素回答问题: (1) T在元素周期表中的位置 ; (2) 这几种元素的氢化物中,水溶液酸性最强的是 (填化学式); YZ2 的熔点 EZ2 的熔点(填高于或低于); (3)E2T2 的电子式 ; (4)工业上制备单质X的化学反应方程式 ; (5)已知1mol晶体Y在足量Z2中燃烧,恢复至室温,放出989.2 kJ 热量,写出该反应的热化学方程式: ; (6)某溶液中可能含有以下阳离子(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+,现取100mL该溶液逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如上图2所示。 ①在实验中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为 ;NaOH溶液的浓度为 mol·L-1 (用字母c、d表示); ②原溶液中含有的Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为 。 【答案】(1)第三周期第ⅦA族;(2)HCl;高于;(3) (4)2NaCl 电解 =2Na+Cl2↑; (5)Si(s)+O2(g)═SiO2(s) ΔH=-989.2 kJ·mol―1 (6)①NH4+ + OH-= NH3·H2O;10/(d-c) mol·L-1 ;② 1:1:1 . 3. 【天津市河东区2016届高三第二次模拟考试化学试题 第7题】/down/2016-5/3/2129553.shtml (7)下表给出五种短周期元素的相关信息。
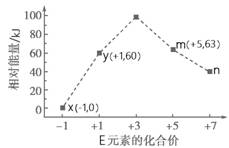
请按要求回答下列问题: (1)D元素核外电子排布 ; (2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。 (3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。 (4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。 【答案】(14分) (1) (3)2N2H4+N2O4==3N2+4H2O (2分)(4)ClO4-(1分) ; 3ClO-(aq) = 2Cl-(aq) +ClO3-(aq) ΔH=-117 kJ·mol-1(2分) (5)Na+>SO32->OH->HSO3->H+(2分)
|