喜讯:2016年高考真题——理科综合化学(北京卷)第28题 共命中48分2016-07-06 17:48:00 阅读 次 参与讨论()
|
喜讯:2016年高考真题——理科综合化学(北京卷)第28题 每题16分 共命中48分 【高考真题】 二、选择题(本题共36分,每小题3分,每题只有一个正确选项) 28.(16分)以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
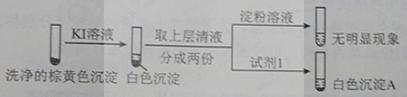
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。 (2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。 已知:Cu+ ①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。 ②通过下列实验证实,沉淀中含有Cu2+和SO32−。
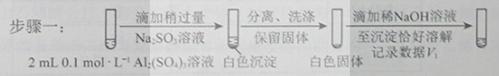
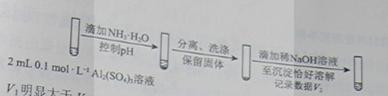
a.白色沉淀A是BaSO4,试剂1是____________。 b.证实沉淀中含有Cu+和SO32−的理由是___________。 (3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。 ①推测沉淀中含有亚硫酸根和________。 ②对于沉淀中亚硫酸根的存在形式提出两种假设: i.被Al(OH)3所吸附; ii.存在于铝的碱式盐中。 对假设ii设计了对比实验,证实了假设ii成立。
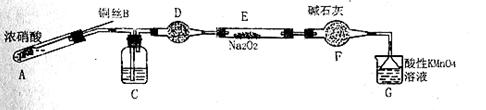
步骤二:_____________(按上图形式呈现)。 (4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。 【答案】(1)2Ag++SO32—=Ag2SO4↓。(2)①加入稀硫酸后,有红色固体生成;②a. HCl和BaCl2溶液。 b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。 (3)①Al3+、OH-。 ②a、 (4)还原性、水解溶液显碱性;两种盐溶液中阴阳离子的性质和反应条件。 【命中试题】 1. 【河北省唐山市2016届高三第二次模拟考试理综化学试题 第26题】 (26) 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行多角度探究: (一)鉴别NaCl和NaNO2 甲同学用沉淀分析法 经查:常温下Ksp(AgNO2)=2×10-8, Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有 溶液的试管。 乙同学侧定溶液pH 用pH试纸分别测定0.1 mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是 (用离子方程式解释)。 (二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠 2. 已知:① 2NO+ Na2O2 = 2NaNO2 ; ② 酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+· (1)使用铜丝的优点是 。 (2)装置A中反应方程式为 。 装置C 中盛放的药品是 ;(填字母代号) A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳 仪器F的作用 。 (3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
① 第一次实验数据出现异常,造成这种异常的原因可能是 (填字母代号)。 A.锥形瓶洗净后未干燥 B.酸式滴定管用蒸馏水洗净后未用标准液润洗 C.滴定终点时仰视读数 ②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为 。 ③该样品中亚硝酸钠的质量分数为 。 【答案】(15分) (除标注外其余每空2分)(其它合理答案也给分) (一)NaCl(1分);NO2-+H2O (二)(1)可以控制反应的发生与停止(1分) (2)Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (2分) C(2分) 防止水蒸气进入(1分) (3)① bc 2分)② 6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O (2分)③ 69% (2分) 2.【四川省雅安市2016届高考化学三诊试卷 第9题】 (9)某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。 【提出假设】 假设1:沉淀为Cu(OH)2 假设2:沉淀为 假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2] 【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。 【物质成分探究】 步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤 步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。
请回答下列问题: (1)假设2中的沉淀为 。 (2)假设1中沉淀为Cu(OH)2的理论依据是 。 (3)无水乙醇洗涤的目的____ __。 (4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。 (5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。 (6)乙同学更换B试剂后验证假设3成立的实验现象是 。 (7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。 【答案】(1)CuCO3(2分) (2)碳酸根水解,溶液中含有较多的OH—(2分,或者答双水解,相互促进,或者写出双水解离子方程式或化学方程式均可) (3)利用乙醇的易挥发,带走洗涤的水(2分) (4)假设1(1分) (5)无水CuSO4 (2分) (6)A中蓝绿色固体变黑色,B中固体变蓝,C中有白色沉淀产生(3分) (7)2 CuCO3•3Cu(OH)2或3Cu(OH)2•2 CuCO3或Cu5 (OH)6(CO3)2(3分) 3.【KS5U解析】河北省邯郸市2016届高考化学一模试卷 第26题】 /down/2016-4/17/2109871.shtml (26) 碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。 【定性实验】检验溶液中的阴、阳离子 取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。 (1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______; (2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________ __________; 【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示. (3)碳铵固体应放在________中进行加热. A.试管 B.蒸发皿 C.烧瓶 D.坩埚 (4)从安全的角度考虑,尾气处理的装置可以选用________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。 (6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;_______(填“合理”“不合理”),理由是________。 【答案】(13分)(1)HCO3-、CO32- (各1分,共2分) (2)NH4++OH- (3)A(2分) (4)A(2分) (5) (6)本小题属于开放性试题,若考生只回答“合理”或“不合理”不给分;若考生回答“合理”或“不合理”且理由能做出相应解释,可酌情给分(3分)。例如:考生回答 ①不合理,因为碳铵中可能含有HCO3-,不能与BaCl2产生沉淀,所测得碳元素质量分数不准确。 ②合理,因为碳铵中只含有CO32-,加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。
| ||||||||||||||||||||||||