喜讯:2016年高考真题——理科综合化学(全国I卷)第37题 共命中45分 (7)2016-07-06 17:52:00 阅读 次 参与讨论()
|
喜讯:2016年高考真题——理科综合化学(全国I卷)第37题 每题15分 共命中45分 (7) 【高考真题】 37. (15分) 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题: (1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。 (2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。 (3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。 (6)晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。 【答案】(1)3d104s24p2 ;2; (2)锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π键; (3)GeCl4、GeBr4、GeI4熔沸点依次升高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强; (4)O>Ge>Zn; (5)sp3 ;共价键; (6)①( 【命中试题】 1.【河北省唐山市2016届高三第二次模拟考试理综化学试题 第37 题】 (37)自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。 (1)请写出Fe的基态原子核外电子排布式 。 (2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为 。 (3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3 ①C、N、O三种元素的第一电离能由小到大的顺序为 ②配合物[Cu(NH3)3CO]Ac中心原子的配位数为 ③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 NA。 (4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是 。 (5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是 (用文字描述),与NO3-互为等电子体的分子是 。(填化学式) (6)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氢化亚铜密度的计算式为ρ= g/cm3.(用NA表示阿佛加德罗常数)
【答案】(15分)(除标注外其余每空2分)(1)[Ar]3d64s2 (1分);(2)3s2(1分) (3)①C<O<N ; ②4 ;③sp2杂化、 sp3杂化; 7; (4)MgO晶体所含离子半径小,电荷数多,晶格能大 (1分) (5)正四面体;(1分) SO3或者BF3 (1分)(其它合理答案也给分) (6) 2.【河北省邯郸市2016届高三第一次模拟考试理综化学试题 第37题】 /down/2016-3/21/2079817.shtml (37)新型储氢材料是开发利用氢能的重要研究方向。 (1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。 ①基态Cl原子中,电子占据的最高能层符号为_________,该能层具有的原子轨道数为________。 ②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。 Li、B、H元素的电负性由大到小排列顺序为________。 (2)金属氢化物是具有良好发展前景的储氢材料。 ①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
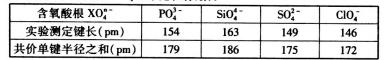
M是________ (填元素符号)。 (3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA) 【答案】(15分) (1)①M(1分) 9(1分) ②正四面体 (2分) sp3(2分) H>B>Li(2分) (2), 3.【福建省厦门市2016届高三下学期第一次教学质量检测理科综合化学试题 第37题】 (37)NO2+和NO2都是常见的配位体,易与金属结合生成配合物。 (1)基态氧原子核外未成对电子数有____个,基态氮原子的核外电子轨道示意图为____。 (2)NO2+和NO2-中氮原子的杂化轨道类型分别为____。 (3)为消除雾霾利用金属氧化物吸收氮的氧化物,MgO、BaO、CaO、SrO吸收氮的氧化物能力由强到弱的顺序为____。 (4)下表为含氧酸根XO4n-的键长数据:
PO43-的空间构型为____。X-O之间的实测键长与理论键长有差异,其原因可能为X-O之间形成了多重键:首先是X原子的____轨道与O原子的2p轨道形成____键;其次是X原子的____轨道与O原子的2p轨道形成____键。 (5)铁有δ、γ两种晶体,如右图所示。两种晶体中距离最近的铁原子间距相同。δ -Fe中铁原子的配位数为____,δ-Fe和γ-Fe的密度之比为____。 【答案】(1)2, (3)BaO >SrO>CaO >MgO 。(4)正四面体形;sp3杂化轨道;δ;3d轨道;π。(5)8,3 |