喜讯:2017年高考真题——化学(江苏卷)第20题 共命中14分2017-06-28 14:14:00 阅读 次 参与讨论()
|
喜讯:2017年高考真题——化学(江苏卷) 砷的应用命中14分 【高考真题】2017年高考真题——理综(江苏卷)第20题 20.(14分)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。 (1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有 (2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_____________________。 ②H3AsO4第一步电离方程式H3AsO4 (3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。
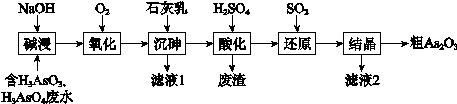
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________________。 ②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是____________________________________。 【答案】(1)碱性溶液吸收了空气中的CO2 (2)①OH- + H3AsO3 (3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加 ②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小加入氧化剂,将三价砷转化为五价砷 【命中试题一】北京市西城区2017届高三4月统一测试(一模)理综试题 Word版含答案/down/2017-4/12/2642512.shtml 26.As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是________。 (2)“氧化”时,1 mol AsO33-转化为AsO43-至少需要O2________mol。 (3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有: a.Ca(OH)2(s) b.5Ca2+ + OH- + 3AsO43- 研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。 (4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
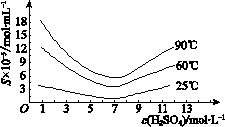
(6)下列说法中,正确的是________(填字母)。 a.粗As2O3中含有CaSO4 b.工业生产中,滤液2可循环使用,提高砷的回收率 c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的 【答案】(1)H3AsO4 + 3NaOH == Na3AsO4 + 3H2O (2)0.5 (3)温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降 (4)H3AsO4 + H2O + SO2 == H3AsO3 + H2SO4 (5)调硫酸浓度约为7 mol·L-1,冷却至25℃,过滤 (6)abc |