喜讯:2017年高考真题——化学(全国Ⅲ卷)第28题 共命中28分2017-06-28 14:47:00 阅读 次 参与讨论()
|
喜讯:2017年高考真题——化学(全国Ⅲ卷) 关于砷的实验题部分应用题命中28分 【高考真题】2017年高考真题——理综(全国Ⅲ卷) 第28题 /down/2017-6/8/2743753.shtml 28.(14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题: (1)画出砷的原子结构示意图____________。 (2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________________________。 (3)已知:As(s)+ H2(g)+ 2As(s)+ 则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。 (4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
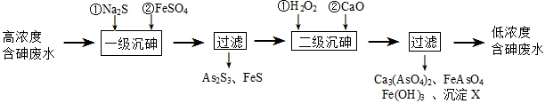
①下列可判断反应达到平衡的是__________(填标号)。 a.溶液的pH不再变化 b.v(I−)=2v( c. c( d. c(I−)=y mol·L−1 ②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。 ③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。 ④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。 【答案】(1) (2) (3)2△H1-3△H2-△H3 (4)①a、c ②大于 ③小于 tm时生成物浓度较低 ④ 【命中试题一】《Ks5u首发》山东省师大附中2017届高三第八次模拟考试化学试题 Word版含答案/down/2017-5/3/2674737.shtml 28.(14分)砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。 I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
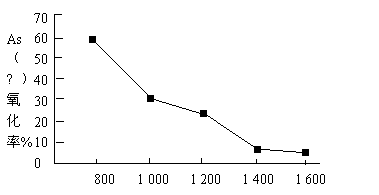
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ②亚砷酸盐的溶解性大于相应砷酸盐。 (1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________。 (2)“一级沉砷”中FeSO4的作用是 ; “二级沉砷”中H2O2与含砷物质反应的化学方程式为 。 (3)沉淀X为 (填化学式)。 Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。 步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。 步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。 步骤3:取1g废渣样品,重复上述实验,未见银镜生成。 (4)AsH3的电子式为_______________。 (5)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是_________________。 【答案】(1) +3(1分) H3AsO4 (3)CaSO4 (4) 【命中试题二】北京市丰台区2017届高三5月综合练习(二模)理综试题 Word版含答案 /down/2017-5/11/2690734.shtml 26.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。 (1)砷与磷为同一主族元素,磷的原子结构示意图为。 (2)根据元素周期律,下列说法正确的是。 a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As (3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO (4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
NaClO投加量 mg/L
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是。 (5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的。 已知:一定条件下,As(Ⅴ)的存在形式如下表所示:
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是。 【答案】(1)(2分) (2)a c(2分) (3)4FeS2+15O2+14H2O (4)起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低。(2分) (5)HClO+H3AsO3 | |||||||||||||||||||||||