喜讯:2017年高考真题——化学(天津卷)第10题 共命中14分2017-06-28 14:51:00 阅读 次 参与讨论()
|
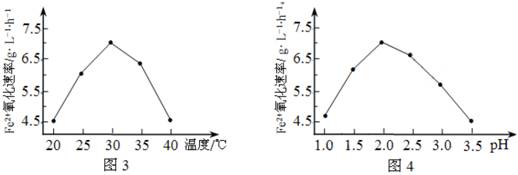
喜讯:2017年高考真题——化学(天津卷) 二氧化硫的除去命中14分 【高考真题】2017年高考真题——化学(天津卷)第10题 10.(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。 Ⅰ.H2S的除去 方法1:生物脱H2S的原理为: H2S+Fe2(SO4)3 4FeSO4+O2+2H2SO4 (1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。 (2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S (3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。 Ⅱ.SO2的除去 方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生 NaOH溶液 (4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化: CaO(s)+H2O (l) 从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。 方法2:用氨水除去SO2 (5)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=_________________mol·L−1。KS5U将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的c( 【答案】(1)降低反应活化能(或作催化剂) (2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性) (3)H2SO4 (4)2OH-+SO2
(5)6.0×10-3 0.62 【命中试题一】天津市南开区2017届高考二模化学试卷 Word版含答案/down/2017-5/12/2692418.shtml 10.(14分)污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
请回答下列问题: (1)上述流程脱硫实现了 (选填下列字母编号)。 a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少 (2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为 。 (3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1 S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1 Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式为: 。 (4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是 。 (5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为: 。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出钢,阳极产物是 。 【答案】(1)a c (2分) (2)2∶3 (2分) (3)MnO2(s)+ SO2(g)= MnSO4(s) △H=-248 kJ·mol-1 (4分) (4)Mn2++2H2O-2e-=MnO2+4H+ (2分) (5)MnO2+H2O+e-= MnO(OH)+OH- (2分) O2 H2SO4 (2分)
|