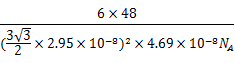喜讯:2017年高考真题——化学(北京卷)第26题 共命中39分2017-06-28 14:55:00 阅读 次 参与讨论()
|
喜讯:2017年高考真题——化学(北京卷) 钛的实际应用题命中39分 【高考真题】2017年高考真题——理综(北京卷)第26题 26.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1 ① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。 ② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
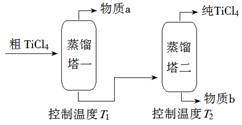
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。 ④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
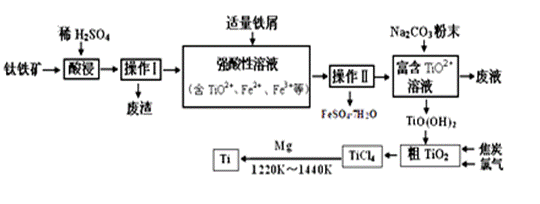
物质a是______________,T2应控制在_________。 【答案】 (1)①TiO2(g)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5kJ/mol ② >、 温度越高,CO的物质的量越多(或CO2的物质的量越少),说明CO2生成CO的反应是吸热反应,所以△H>0。③饱和食盐水、FeCl2溶液、NaOH溶液。④MgCl2、AlCl3、FeCl3 。(2)四氯化硅、136℃~181℃ 【命中试题一】福建省长泰县第二中学2016届高三下学期第一次月考理科综合化学试题 Word版含答案 27.钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下:
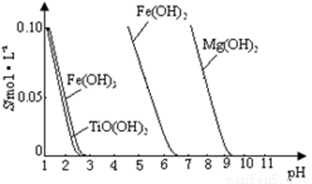
已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。 ③25℃时TiO(OH)2溶度积Ksp=1×10-29
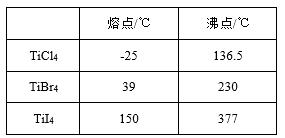
回答下列问题: (1)写出钛铁矿酸浸时,反应的离子方程式 。 (2)操作Ⅱ包含的具体操作方法有 。 (3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是 , TiO2+水解的离子方程式为 ,当溶液pH= 时,TiO(OH)2已沉淀完全。 (4)加入铁屑将Fe3+转化为Fe2+的原因是 。 【答案】(1)FeTiO3+4H+ = TiO2++Fe2++2H2O (3)调节溶液pH,促进TiO2+水解 TiO2++2H2O (4)避免使Fe3+和TiO2+共沉淀。 【命中试题二】《Ks5u首发》《泄露天机》陕西省西安市第一中学2017届高三高考押题卷 理综(二)教师版 Word版含答案/down/2017-5/17/2700597.shtml 35.钛(22Ti)铝合金在航空领域应用广泛。回答下列问题: (1)基态Ti原子的核外电子排布式为[Ar]___________,其中s轨道上总共有__________个电子。 (2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是_______,配体是_________。 (3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生 下列聚合反应: n CH3CH=CH2 性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的 立体构型是直线形的是____________。 (4)钛与卤素形成的化合物的熔沸点如下表所示,
分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是___________________________。
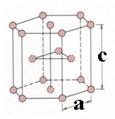
【答案】(1)3d24s2 (1分) ; 8(1分) (2)+4(1分);F-(1分) (3)sp2、sp3 (1分); Cl (2分); CO2(2分) (4)TiCl4、TiBr4 、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间 作用力逐渐增大,因而三者的熔点和沸点依次升高。(2分) (5) 【命中试题三】山东省济宁市2017届高三第二次模拟考试理综化学试题 Word版含答案 /down/2017-5/15/2695559.shtml 35.钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属。回答下列问题: (1)基态钛原子的价电子排布式为_________________。金属钛晶胞如图所示,晶胞参数a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为______堆积(填堆积方式),其中钛原子的配位数为__。 (2)现有Ti3+的配合物[TiCl(H2O)5]Cl2·H2O。该配合物的配体是_________,配位数是_______。 (3)C、N、O等元素可与钛形成二元化合物。C、N、O元素的电负性由大到小的顺序是__________。已知:中心原子相同时,配位原子的电负性越大,键角越小;配位原子相同时,中心原子的电负性越大,键角越大,则NF3、PF3、NH3的键角由大到小的顺序为_____________,乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因______________。 (4)钙钛矿晶体的结构如图所示。晶体的化学式为____________________。晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,
【答案】(1)3d24s2(1分)六方最密(1分)12(1分) (2)H2O、Cl-(2分)6(1分) (3)O>N>C(1分)NH3>NF3>PF3(2分) 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键(2分) (4)CaTiO3(2分)(
| ||||||||||||||||||||||||