喜讯:2019年高考真题——理综化学(全国卷Ⅰ)第27题(命中100分)2019/7/29 9:16:00 阅读 次 参与讨论()
|
喜讯:2019年高考真题——理科综合(全国卷Ⅰ)
【高考真题】2019年高考真题——理科综合(全国卷Ⅰ) 第27题 https://www.ks5u.com/down/2019-6/9/3700680.shtml 27.(15分) 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题: (1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。 (2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。 (4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。 (5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。 【答案】(1)碱煮水洗 (2)加快反应 热水浴 C (3)将Fe2+全部氧化为Fe3+;不引入杂质 防止Fe3+水解 (4)加热浓缩、冷却结晶、过滤(洗涤) (5)NH4Fe(SO4)2·12H2O
【命中试题1】12分 江苏省苏锡常镇四市2019届高三二模考试(十)化学试卷Word版含答案https://www.ks5u.com/down/2019-7/12/3734181.shtml
16. (12分)以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:
已知:FeO在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。 (1) “酸浸”时加入硫酸的量不宜过多的原因是_____________________________________________________。
(3) 在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是______________________________________________________。 (4) “过滤2”产生的滤渣的主要成分为________(填化学式),“过滤3”所得滤液中含有的阴离子有OH-、Cl-、SO、____________、____________(填化学式)。 (5) K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为________。 【答案】 (1) 可以减少“氧化”步骤中NaOH的用量(2分) (2) 2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O(2分) (3) 当硫酸铁跟氢氧化钠的质量比增大到一定程度时,过多的Fe3+与NaOH反应生成Fe(OH)3,Fe(OH)3可以加速K2FeO4的分解,从而使K2FeO4的产率下降(2分) (4) Mg(OH)2(2分) FeO、AlO(每空1分,共2分) (5) 8∶3(2分)
【命中试题2】12分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml
18. (12分)以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备硫酸锰晶体的工艺流程如下:
(1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为_________________________________。 (2)实验室常用氧化还原法测定MnSO4·H2O晶体的纯度,原理如下: 2Mn2++NO+4PO+2H+===2[Mn(PO4)2]3-+NO+H2O NH+NO===N2↑+2H2O [Mn(PO4)2]3-+Fe2+===Mn2++[Fe(PO4)2]3- 称取MnSO4·H2O样品1.000 0 g,溶于适量水,以磷酸作配位剂,加入过量硝酸铵,在220~240 ℃下充分反应。然后以N—苯代邻氨基苯甲酸作指示剂,用0.100 0 mol·L-1硫酸亚铁铵标准溶液滴定生成的[Mn(PO4)2]3-至终点。重复操作3次,记录数据如下表:
①已知:Fe2++NO+2H+===Fe3++NO↑+H2O。 测定过程中,硝酸铵的作用是____________________和____________________。 ②若滴定过程中标准溶液硫酸亚铁铵不是新配置的,所测定的MnSO4·H2O晶体的纯度将会________(填“偏高”“偏低”或“不变”)。 ③计算样品中MnSO4·H2O的质量分数(写出计算过程)。 【答案】 (1) MnO2+MnS+2H2SO4===2MnSO4+S+2H2O(2分) (2) ①将试样中的二价锰定量氧化成三价锰(1分) 与产生的亚硝酸盐反应消除对滴定的影响(1分) ②偏高(2分) ③消耗(NH4)2Fe(SO4)2标准溶液平均值为20.00 mL。(1分) 2MnSO4·H2O~2[Mn(PO4)2]3-~2Fe2+(1分) n(MnSO4·H2O)=n(Fe2+)=20.00 mL×10-3 L·mL-1×0.100 0 mol·L-1=2×10-3 mol(2分) 样品中MnSO4·H2O的质量分数为:×100%=33.8%(2分)
【命中试题3】15分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml
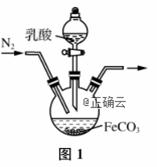
19. (15分)以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。 (2)向溶液1中加入过量铁粉的目的是_______________________________________________。 (3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________ ________________________________________________________________________。 (4)实验室制备乳酸亚铁的装置如图1所示。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是________________________________________________________________________。 (5)已知: ①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。 ②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。
图2图3 由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________ ________________________________________________________________________。 (实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。 【答案】 (1) CuFeS2+3Fe3++Cl-===4Fe2++CuCl+2S(2分) (2) 除去溶液中的Fe3+,提高产品的纯度(2分) (3) 取最后一次洗涤后的滤液,滴加硝酸酸化的AgNO3溶液,若无白色沉淀,则洗涤完全(2分) (4) ①排尽装置中的空气,防止Fe2+被氧化(2分) ②KMnO4具有强氧化性,可将Fe2+和乳酸根离子中的羟基一同氧化(2分) (5) 过滤(1分)。控制温度60 ℃左右(1分),向滤液中滴加0.1 mol·L-1 H2SO4,控制溶液的pH为2.0~2.5左右,搅拌、趁热过滤(1分)。用乙醇洗净所得固体(1分),置于真空干燥箱中干燥(1分)(共5分)
【命中试题4】7分 辽宁省本溪高级中学2019届高三二模考试化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/11/3731731.shtml 19、海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发 利用的部分工艺流程图如下。回答下列问题:
(1) 精制食盐水时,用到的下列物质中有(填序号)。 ① NaOH溶液 ② 盐酸 ③ K2CO3溶液 ④ BaCl2溶液 ⑤ 硫酸 ⑥ Na2CO3溶液 ⑦ Ba(NO3)2溶液 (2) 工业上经过步骤②、③、④制备Br2。步骤②中Cl2氧化Br—应在(填酸性或碱性) 条件下进行;步骤③Br2可用热空气吹出,其原因是。 (3) 为了除去工业Br2中微量的Cl2,可向工业Br2中。 a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液 (4) 若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 (写出加入的试剂和操作)。 【答案】(1) ①②④⑥ ( 2分) (2) 酸性 (1分) Br2沸点低,易挥发 (1分) (3) c ( 1分) (4) 加入MgCl2( 不能用MgSO4)浓溶液搅拌、过滤、洗涤( 2分)
【命中试题5】19分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/4/3724414.shtml 27 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 (2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。 (3)步骤④调滤液2的pH使之变____________(填“大”或“小”) (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。 a.80℃ b.60℃ c.40℃ d.10℃
【答案】 (1)[Ar]3d5或 1s22s22p63s23p63d5 (2)sp2和sp3 9 mol (3)H<C<O (4)乙醇分子间存在氢键 (5)Fe3CuN
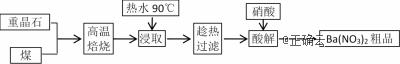
【命中试题6】20分 贵州省贵阳市第二中学2019届高三测试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/4/3724391.shtml 9.重晶石主要成分为BaSO4,含少量的SiO2、CaO和MgO杂质,以下是一种制取Ba(NO3)2的工业流程。
(1)上述流程中将重晶石和煤磨成粉状的目的是_______________________。 (2)焙烧过程中主反应为:BaSO4 + 4C
①依据如图判断生成BaS的反应是_______反应(填“放热”或“吸热”);反应温度至少应控制在____以上。 ②控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响,如图所示,判断原料中n(C) / n(BaSO4)至少为________(填字母):a. 1.5 、b. 2.0 、c.3.75。 (3)已知BaS的溶解度随温度的升高而明显增大,90℃时约为50g/100g水,浸取液中存在三种碱Mg(OH)2 、Ca(OH)2、Ba(OH)2。 ①浸取过程中产生Ba(OH)2的原因是________________________(写离子方程式)。 ②三种碱的碱性由强到弱顺序为:_________>_______>________(填化学式);结合元素周期律解释原因是:Mg、Ca、Ba处于同一主族,随着原子序数递增,________。 (4)酸解过程中,向滤液中加入硝酸,即有硝酸钡晶体析出,稍过量的HNO3有利于提高Ba(NO3)2晶体的析出率,用化学平衡原理分析其原因是:__________________________。 【答案】 (1). 增大固体接触面积,加快反应速率,提高转化率 (2). 吸热 (3). 600℃ (4). c (5). S2-+ H2O
【命中试题7】15分 内蒙古北方重工业集团有限公司第三中学2019届高三第二次模拟考试化学试题 Word版含答案 https://www.ks5u.com/down/2019-6/28/3719279.shtml 27.硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度. 已知:(1) (NH4)2SO4、FeSO4·7H2O、(NH4)2SO4·FeSO4·6H2O在水中溶解度如表
(2)莫尔盐在乙醇溶剂中难溶。 I.莫尔盐的制取流程如图 (2)步骤2中加热方式(填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是;。 (3)步骤3中包含的实验操作名称. (4)产品莫尔盐最后用洗涤(填字母编号).a.蒸馏水 b.乙醇 c.滤液 Ⅱ.为测定硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,设计了如下两个实验方案,请回答: 方案一:取20.00mL硫酸亚铁铵溶液用a mol·L—1的酸性KMnO4溶液进行滴定,消耗b mL酸性KMnO4溶液, 则该硫酸亚铁铵晶体的纯度为。 方案二:取20.00mL硫酸亚铁铵溶液进行如图实验.
若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为。 【答案】 I.(1)热的Na2CO3碱性强,油脂易溶于碱性溶液 (2)水浴加热;(1分) 少量铁可Fe2+被氧化Fe3+防FeSO4温度低时结晶析出 (3)蒸发浓缩、冷却结晶、…… (4)b Ⅱ.782Fe2+易被氧化成Fe3+,故方案一测得硫酸亚铁铵浓度偏小
|