喜讯:2019年高考真题——理综化学(全国卷Ⅰ)第26题(命中72分)2019/7/29 9:17:00 阅读 次 参与讨论()
|
喜讯:2019年高考真题——理科综合(全国卷Ⅰ)
(命中72分) 【高考真题】2019年高考真题——理科综合(全国卷Ⅰ) 第26题 https://www.ks5u.com/down/2019-6/9/3700680.shtml 26.(14分) 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题: (1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。 (2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。 (3)根据H3BO3的解离反应:H3BO3+H2O (4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。 【答案】 (1)NH4HCO3+NH3 (2)SiO2、Fe2O3、Al2O3 KSCN (3)一元弱 转化为H3BO3,促进析出 (4)2Mg2++3 (或2Mg2++2
【命中试题1】15分 江苏省苏锡常镇四市2019届高三二模考试(十)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/12/3734181.shtml
19. (15分)硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。 ②Na2CrO4溶液中加酸调节pH为3.5时,CrO转化为Cr2O。 ③相关物质在不同温度时溶解度如下表:
(1) “酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为____________________________________。“酸浸”时需控制温度为90 ℃左右,可以采用的加热方式是________________。 (2) “过滤”前,适当加热的目的是_________________________________________________________。 (3) 对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____________________________ ____________________________。 (4) “过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。 ①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为________________________________________。 ②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,________________________________________________________________________ ____________________________,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
【答案】 (1) Ni+H2SO4===NiSO4+H2↑(2分) 90 ℃水浴加热(2分) (2) 使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀(2分) (3) 取少量最后一次洗涤过滤液于试管中,先用盐酸酸化,再加入BaCl2溶液,若无沉淀生成,则已洗净(2分) (4) ①4Cr(OH)3+4Na2CO3+3O24Na2CrO4+4CO2+6H2O(2分) ②向滤液中加入硫酸调节pH至3.5,将溶液加热到90 ℃(以上)蒸发结晶,有大量无色晶体析出,至有少量橙红色晶体析出时趁热过滤,滤液降温至40 ℃结晶,过滤,用蒸馏水洗涤,干燥得Na2Cr2O7晶体(5分)
【命中试题2】12分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml
16. (12分)目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。 (2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。 (3)滤渣1的成分为________。
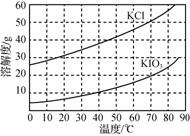
(5)“制KIO3溶液”时,发生反应的离子方程式为______________________________________________________。 (6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为_______________________________________________________。 【答案】 (1) 淀粉溶液(2分) (2) SO2+I2+2H2O===SO+2I-+4H+(或2SO2+I2+2Cu2++4H2O===2CuI↓+2SO+8H+)(2分) (3) Fe、Cu(2分,各1分) (4) 6.0(2分) (5) 5Cl2+I2+12OH-===2IO+10Cl-+6H2O(2分) (6) 蒸发浓缩,降温结晶(2分,各1分)
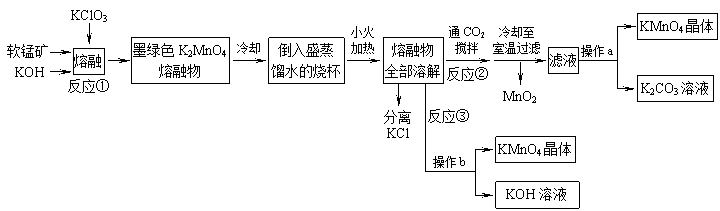
【命中试题3】12分 辽宁省本溪高级中学2019届高三二模考试化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/11/3731731.shtml 20、高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4, 下图是实验室制备高锰酸钾的操作流程。
已知:
请回答: (1) 反应①的化学方程式为, 加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的 仪器有,不采用瓷坩埚而选用铁坩埚的理由是 (2) 反应②中氧化产物与还原产物的物质的量之比为; 上述流程中可以循环利用的物质是。 (3) 实验时,从滤液中得到KMnO4晶体的实验操作a为, 若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是 。 【答案】 (1) KClO3 + 3MnO2 + 6KOH 酒精灯、坩埚钳( 2分) 瓷坩埚中的SiO2会与KOH发生反应( 1分) (2) 2∶1 ( 1分) KOH、MnO2( 2分) (3) 蒸发浓缩、冷却结晶、过滤、洗涤、干燥( 2分) (4)KHCO3的溶解度较小,滤液蒸发浓缩降温结晶时KHCO3会随KMnO4一同结晶析出。( 2分)
【命中试题4】21分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/4/3724414.shtml 26 (每空3分,计21分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。 (2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
①将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。 a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温 ②若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。 (3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4 ②写出硫酸亚铁高温分解反应的化学方程式_____________________。 【答案】 (1)样品中没有Fe3+ Fe2+易被氧气氧化为Fe3+
(2)① dabfce ② 偏小 (3)①c、a 生成白色沉淀、褪色 ②2FeSO4
【命中试题5】12分 贵州省贵阳市第二中学2019届高三测试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/4/3724391.shtml 8.乙烯来自石油的重要化工原料,其产量是一个国家石油化工水平的标志,根据以下实验,请回答下列问题:
(1)实验之前需要对该装置进行气密性的检查,具体操作为:______ (2)石蜡油分解实验产生的气体的主要成分是______(填写序号); ①只有甲烷②只有乙烯③烷烃与烯烃的混合物 (3)实验过程中装置B中的现象为_________,若装置D中产生了白色沉淀,则说明装置C中发生反应的离子方程式为______________; (4)该实验中碎瓷片的作用是______(填序号); ①防止暴沸②有催化功能③积蓄热量④作反应物 (5)将分解产生的气体混合物全部通入到足量溴水中,溴水增重mg,则该气体混合物中属于烯烃的原子个数为__________(用NA表示); (6)利用A装置的仪器还可以制备的气体有______(任填一种),产生该气体的化学方程式为_____。 【答案】 (1). 微热A中
| ||||||||||||||||||||||||||||||||