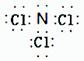喜讯:2019年高考真题——理综化学(全国卷Ⅰ)第28题(命中93分)(2)2019/7/30 9:57:00 阅读 次 参与讨论()
|
喜讯:2019年高考真题——理科综合(全国卷Ⅰ)
【高考真题】2019年高考真题——理科综合(全国卷Ⅰ) 第28题 https://www.ks5u.com/down/2019-6/9/3700680.shtml 28.(14分) 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题: (1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。 ②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。 根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。 (2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。 A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50 (3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
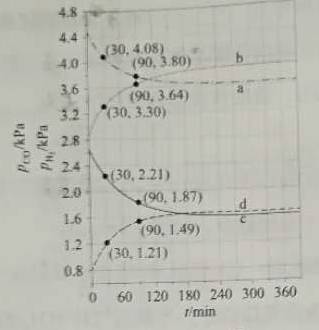
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。 (4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
计算曲线a的反应在30~90 min内的平均速率 【答案】 (1)大于 (2)C (3)小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*=== H*+OH*) (4)0.0047 b c a d
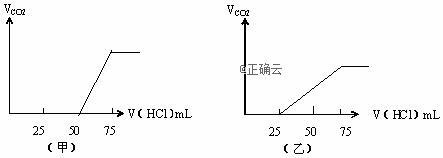
【命中试题7】8分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/4/3724424.shtml 26.(8分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
试分析: ⑴NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是 甲:其物质的量之比是: 乙:其物质的量之比是: ⑵且在两种情况下产生的CO2气体(标准状况)各是甲:mL;乙:mL。 ⑶原NaOH溶液的物质的量浓度是;若以Na2O2固体溶于水配得100mL溶液需称量Na2O2g 【答案】 ⑴NaOH,Na2CO3;1:1;NaHCO3和Na2CO3;1:1; ⑵56mL;112mL;⑶0.75mol/L;2.9g
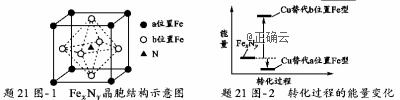
【命中试题8】19分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/4/3724414.shtml 28(1~4题每空3分,第5题4分,计19分) 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。 (1)Fe3+基态核外电子排布式为____________________。 (2)丙酮( (3)C、H、O三种元素的电负性由小到大的顺序为________________。 (4)乙醇的沸点高于丙酮,这是因为____________________。 (5)(4分)某FexNy的晶胞如题21图−1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x−n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图−2 所示,其中更稳定的Cu替代型产物的化学式为___________。
【答案】 (1)2∶7 陶瓷在高温下会与Na2CO3反应 (2)铁 Al(OH)3 (3)小 (4)d
【命中试题9】18分 贵州省贵阳市第二中学2019届高三测试(十一)化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/4/3724391.shtml 10.十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。 (1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:主反应:a.4NH3(g)+4NO(g)+O2(g) 副反应:b.4NH3(g)+3O2(g) c.4NH3(g)+5O2(g) ①上述反应中利用了NH3的__________性质;△H1=____________。 ②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图1,试分析脱硝的适宜温度是______(填序号)。A <850℃ b 900~1000℃ c >1050 ℃ 温度超过1000 ℃,NO浓度升高的原因是_____________。
(2)已知:8NH3(g)+6NO2(g) ①该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是____________,理由是___________。 ②下列说法正确的是_______(填标号)。 a 使用催化剂A达平衡时,△H值更大 b 升高温度可使容器内气体颜色加深 c 单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡 d 若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡 (3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) ①达到平衡后,仅升高温度,k正增大的倍数_______(填“>”“<”或“=”)k逆增大的倍数。 ②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 【答案】 (1). 还原性 (2). -1626.9 kJ/mol (3). b (4). 高温下,副反应c,产生了NO;主反应a正反应为放热反应,升高温度,平衡逆向移动,也会导致NO的浓度增大 (5). Ea(C) ˃ Ea(B) ˃ Ea(A) (6). 相同时间内生成的N2越多,反应速率越快,活化能越低 (7). b c d (8). < (9).
【命中试题10】20分 贵州省贵阳市第二中学2019届高三测试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/4/3724391.shtml 11. 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题: (1)CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是_______。 (2)下列基态原子或离子的价层电子排布图正确的______。
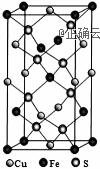
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。 ①X分子的立体构型是____,中心原子杂化类型为____,属于_______(填“极性”或“非极性”)分子。 ②X的沸点比水低的主要原因是___________。 (4)CuFeS2与氧气反应生成SO2,其结构式为 (5)四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为__________, ②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g•cm3(列出计算式)。 【答案】 (1). 离子键 (2). 硫(S) (3). CD (4). V形 (5). sp3 (6). 极性 (7). 水分子间存在氢键(答案合理即可) (8). σ键和π键 (9). 4 (10).
【命中试题11】13分 内蒙古北方重工业集团有限公司第三中学2019届高三第二次模拟考试化学试题 Word版含答案 https://www.ks5u.com/down/2019-6/28/3719279.shtml 26.(13分) I.NH3与NO2是常见的氮的化合物,研究它们的综合利用有重要意义。 (1)NO2产生的环境问题有 (填一种)。 (2)热电厂通常用NH3消除燃煤烟气中NO2,写出该反应化学方程式 。 (3)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式 。 Ⅱ.(4) K2FeO4是高效环保净水剂,工业上可用电解法制备:Fe+2KOH+2H2O (5) α 铁触媒是合成氨工业中所用的催化剂,其主要成分是FeO和Fe2O3,当其中FeO与Fe2O3的物质的量之比为1∶1时,其催化活性最高。 ① 写出由C(炭粉)与Fe2O3在高温下反应制备α 铁触媒的化学方程式(另一种产物可溶于水) _____________________________________________________________; ② 为制得这种催化剂,应向480 g Fe2O3粉末中加入C(炭粉)的质量为________g。 【答案】 (1)光化学烟雾污染(或酸雨、臭氧层空洞等)(1分) (2) (3) (4)Fe-6e-+8OH-===FeO+4H2O (5)① 2Fe2O3+C4FeO+CO2↑ ② 6
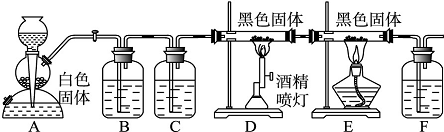
【命中试题12】15分 内蒙古北方重工业集团有限公司第三中学2019届高三第二次模拟考试化学试题 Word版含答案 https://www.ks5u.com/down/2019-6/28/3719279.shtml 28.(15分) 下图是验证CO气体还原性的实验装置图:
已知F中装有澄清的石灰水,请根据上述实验目的和实验装置图,填写下列空白: (1)图中各装置中的试剂分别为:A________、D________ (从下列试剂中选择最佳试剂)。从实验结果的可靠性方面说明选择C中试剂的理由_________________________________________。 a.浓硫酸 b.稀硫酸 c.饱和NaHCO3液 d.NaOH液 e.蒸馏水 f.饱和食盐水 g.稀盐酸 h.浓盐酸 j.石灰石 k.苏打 l.小苏打 m.二氧化锰 n.碳粉 p.氧化铜 q.碱石灰 (2)从实验安全角度考虑,在给D、E中的反应管加热之前进行的实验操作__________________________。 (3)证明CO有还原性的实验现象_________________________________________________________。 (4)某同学认为该实验装置设计有缺陷,请改进_____________________________________________。 (5)如果要通过F中的现象来证明CO的还原性,则该实验装置图中_____之间缺少的一个重要装置是装有_____[从第(1)问的试剂中选择]的____(填仪器名称)。 【答案】 (1)g和j n (1分)避免水蒸气与C反应生成H2,对干扰CO验证 (2)打开A中活塞产生CO2排尽装置中O2 (3)E反应管内黑色固体变为红色 (4)在F后面增加尾气处理装置 (5) D、E q(1分) 干燥管(或者U形管)
|