喜讯:2018年高考真题——理综化学(全国卷II)第35题命中72分2018/7/13 11:38:00 阅读 次 参与讨论()
|
【高考真题】2018年高考真题——理科综合(全国卷II)Word版含答案/down/2018-6/8/3243689.shtml35.[化学——选修3:物质结构与性质](15分) 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
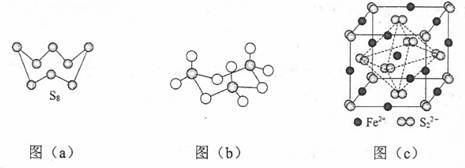
回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。 (2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是_________。 (3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。 (5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm−3;晶胞中Fe2+位于 答案35.(15分) (1) (2)H2S (3)S8相对分子质量大,分子间范德华力强 (4)平面三角 2 sp3 (5)
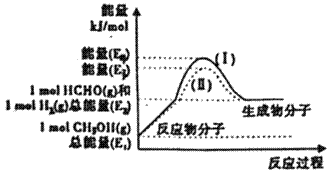
【命中试题一】2018年普通高等学校招生全国统一考试最新高考信息卷(八)理综 word版含解析http://www.ks5u.com/down/2018-5/25/3219761.shtml26.(14分)由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。 Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题: (1)对甲烷而言,有如下两个主要反应: ①CH4(g) +1/2O2(g) =CO(g) +2H2(g) △H1=-36kJ·mol-1 ②CH4(g) +H2O(g) =CO(g) +3H2(g) △H2=+216kJ·mol-1 若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为_______。 (2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
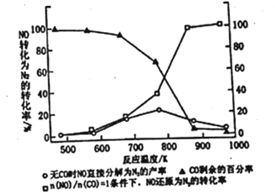
①写出上述反应的热化学方程式________________________________。 ②反应热大小比较:过程I________过程II (填“大于”“小于”或“等于”)。 II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,则得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol) 如下表:
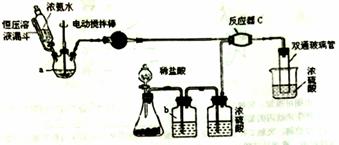
①写出NO与活性炭反应的化学方程式_________________________________________; ②若T1<T2,则该反应的ΔH_________0 (填“>”“<”或“=”) ; ③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。 【答案】(1)6NA (2)①CH3OH(g)=HCHO(g)+H2(g) ΔH=+(E2-E1)kJ/mol ②等于 (3)NO分解反应是放热反应,升高温度不利于反应进行(只写升高温度不利于反应进行也得满分,其他合理说法也得分) 870(接近即可给分) (4)①C +2NO 【命中试题二】2018年普通高等学校招生全国统一考试最新高考信息卷(二) 理综 word版含解析http://www.ks5u.com/down/2018-5/25/3218461.shtml26.(14分)氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:
(1) 写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。 (2) 恒压滴液漏斗的作用是________。 (3) 有同学建议该CO2发生装置直接改用 (4) 反应器C中发生反应的化学方程式为________ 。 (5) 双通玻璃管的作用________;b中溶液的作用________ 。 (6) 上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。 ①设计方案,进行成分探究,请填写表中空格。 限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
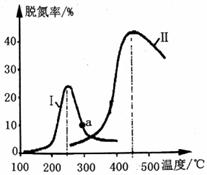
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。 【答案】(1)新制生石灰(NaOH固体、碱石灰均可)(1分) CaO+NH3·H2O==Ca(OH)2+NH3↑ CaO吸水且放热促进氨气生成。(填“NaOH固体”则要“放热且降低氨气溶解度促进氨气放出”,合理即可)(2分) (2)平衡压强,使漏斗内液体顺利滴下(1分) (3)①装置简单,无需干燥;②低温环境,提高产率(答其中一点即可)(1分) (4)2NH3+CO2==H2NCOONH4 (2分) (5)防止倒吸 吸收氯化氢气体(2分) (6)①(NH4)2CO3(1分);Ba(OH)2(1分);NH4HCO3(1分) ②85.0%(0.85)(2分) 【命中试题三】2018年普通高等学校招生全国统一考试最新高考信息卷(二) 理综 word版含解析http://www.ks5u.com/down/2018-5/25/3218461.shtml28.(15分)工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。 Ⅰ.NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) (1)已知:CO燃烧热的ΔH1=-283.0kJ·mol-l, N2(g)+O2(g) (2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
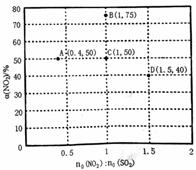
①以下说法正确的是__________________(填字母)。 A.两种催化剂均能降低活化能,但ΔH不变 B.相同条件下,改变压强对脱氮率没有影响 C.曲线Ⅱ中的催化剂适用于450℃左右脱氮 D.曲线Ⅱ中催化剂脱氮率比曲线I中的高 ②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。 Ⅱ.SO2的综合利用 (3)某研究小组对反应NO2+SO2
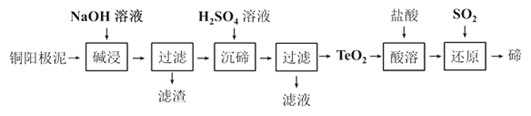
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。 ②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”“=”或“<”)。 (4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的 【答案】(1)﹣746.5kJ/mol (2分) (2)①A、C (2分) ②温度较低时,催化剂的活性偏低 (1分) 不是平衡脱氮率,因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高 (2分) (3)①降低温度(1分) ② =(2分) (4)6.0×10﹣3 (2分) 2.24(3分) 【命中试题四】2018年普通高等学校招生全国统一考试最新高考信息卷(九)理综 word版含解析http://www.ks5u.com/down/2018-5/25/3219768.shtml27.(15分)碲(Te)的单质和化合物在化工生产等方面具有重要应用。 (1)下列关于碲及其化合物的叙述正确的是__________ A.Te 位于周期表的第五周期 Ⅳ A 族 B.Te 的氧化物通常有TeO2和TeO3 C.H2TeO4的酸性比H2SO4的酸性强 D.热稳定性H2Te比H2S弱,但比HI 强 (2)25℃ 时,亚碲酸(H2TeO3)的Ka1 = 1×10‾3,Ka2 = 2×10‾8,0.1 mol/L H2TeO3溶液中H2TeO3的电离度α约为______________ (3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含TeO2,还含有少量Ag、Au)为原料制备单质碲,其工艺流程如图:
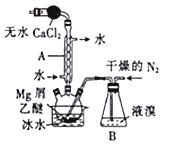
①“碱浸”时TeO2发生反应的化学方程式为_______________________。 ②“沉碲”时控制溶液的 pH 为 4.5~5.0,生成TeO2沉淀,酸性不能过强的原因是_______________________________________________;防止局部酸度过大的操作方法是_______________________________; ③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是______________________________________; ④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的反应式为_________________________________________________。 【答案】(1)B (2)10% (3)< (4)TeO2 + 2NaOH = Na2TeO3 + H2O (5) TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应 (6)缓慢加入H2SO4溶液,并不断搅拌 (7)TeCl4 + 2SO2 + 4H2O = Te + 4HCl + 2H2SO4 (8)TeO32‾ + 3H2O + 4e‾ = Te + 6OH‾ 【命中试题五】2018年普通高等学校招生全国统一考试最新高考信息卷(十)理综 word版含解析http://www.ks5u.com/down/2018-5/25/3219775.shtml26.(14分)溴化镁(MgBr2)可由金属镁在室温下与干燥后的溴在乙醚中反应制得,利用如图所示装置制备溴化镁,并测定其产率。已知: ①Mg和Br2反应剧烈且放热,MgBr2具有强吸水性; ②MgBr2+3C2H5OC2H5===MgBr2·3C2H5OC2H5。
(1)保存液溴时在瓶内加入适量的蒸馏水,其目的是___________。 (2)球形干燥管中放入无水CaCl2 的作用是______________,仪器A的名称是________。 (3)实验时,应缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。如果将所用液溴一次性全部加入三颈烧瓶中,其后果是___________________。 (4)反应完毕后恢复至室温过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得到三乙醚合溴化镁(MgBr2·3C2H5OC2H5)粗品。第一次过滤得到的固体物质是_______。 (5)常温下用苯溶解粗品,冷却至0 ℃,析出晶体,经操作a得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。 ①操作a是________________。 ②写出三乙醚合溴化镁加热至160℃分解得无水MgBr2的化学方程式:_______________。 (6)反应开始前装入5.0g镁屑和150mL无水乙醚,无水MgBr2在干燥器中冷却到室温后,称量,其质量为29.8g。则该实验制取MgBr2的产率是__________(保留一位小数)。 【答案】(1)防止液溴挥发 (2)防止空气中的水蒸气进入反应装置 球形冷凝管 (3)反应过于剧烈,使反应过程难以控制 (4)镁屑 (5)①过滤、洗涤 ② MgBr2·3C2H5OC2H5 MgBr2+3C2H5OC2H5 (6) 77.7%
推荐给好友:【/News/2018-7/164509】
|